文献研读|李芷瑜(2019级硕士):Nature|单细胞蛋白质组学对细胞周期的时空剖析
2021/3/24
摘要:Spatiotemporal dissection of the cell cycle with single-cell proteogenomics生命得以不断繁衍生息源于循环往复的细胞周期,包括生长和分裂。细胞在累积足够的营养物质、再通过一系列生长检查点后一分为二。细胞周期由特定的蛋白质在时间和空间上精准调控,这就产生了单个细胞之间的差异性。近日,来自瑞典斯德哥尔摩皇家理工学院的Emma Lundberg博士和同事提出了一个全面的时空图谱——从亚细胞层面的蛋白质组数据和单细胞转录组数据对细胞周期中单个细胞进行精确时间测量。
作者简介:现年40岁的Emma Lundberg博士是人类细胞图谱计划(Cell Atlas)的主任,在瑞典斯德哥尔摩皇家理工学院(KTH)获得了生物技术硕士和博士学位后,现在领导着KTH蛋白质组和纳米生物技术部门的Cell Profiling小组,致力于从亚细胞水平定义人类蛋白组的时空组织(spatiotemporal organization),并理解定位的变化和偏差是如何影响细胞的功能和疾病。细胞生长和分裂的细胞周期是生命的基本过程。它的失调会带来毁灭性的后果。细胞周期由蛋白质在时间和空间上的精确调节驱动,这在个体增殖细胞之间产生了差异性。
(Emma Lundberg近照)
文献摘要:研究者通过将亚细胞分辨率的蛋白质组数据与单细胞转录组数据和细胞周期中单个细胞的精确时间测量相结合,展示了人类蛋白质组异质性的全面时空图谱。本研究显示大约五分之一的人类蛋白质组显示出细胞间的差异性,还识别出数百种以前未知的与有丝分裂和细胞周期相关的蛋白质,并提供证据表明其中一些蛋白质具有致癌功能。结果表明,细胞周期进程解释了不到一半的细胞间差异,大多数循环蛋白是在翻译后调节的,而不是由转录周期调节的。这些蛋白质被调节细胞命运的激酶过度磷酸化,而细胞间变化的非循环蛋白质更有可能被调节代谢的激酶修饰。这种细胞周期的空间分辨蛋白质图谱被整合到人类蛋白质图谱中,并将作为加速人类细胞周期和细胞增殖的分子研究的资源。
结果与讨论:
1. 利用成像蛋白基因组学对细胞间异质性的时间剖析
研究者通过HPA抗体、免疫荧光技术和共聚焦显微镜绘制人类蛋白质图谱(Human Protein Atlas, HPA),在亚细胞层面上定位蛋白质。大部分蛋白质在表达水平和空间分布上显示出细胞间的异质性(Fig.1a),在一个以上人类细胞系中显示出相似的细胞间差异(Fig.1b),表明这些细胞间蛋白质组差异由保守的调节机制控制。
如果一种蛋白质定位于有丝分裂结构,它可能直接与细胞周期相关联。这项研究发现有230种蛋白质定位于一个或几个有丝分裂结构中,包括细胞动力桥、有丝分裂染色体、纺锤体、中间体、中间体环、着丝粒、卵裂沟,其中大约有一半第一次被证明与细胞周期相关(Fig.1d)。为了确定观察到的细胞间差异是否与细胞分裂间期进展相关,研究人员使用基于荧光泛素化的细胞周期指示剂(fluorescent ubiquitination-based cell cycle indicator, FUCCI) U2OS细胞进行了靶向单细胞成像蛋白基因组学分析(Fig.1e)。在鉴定到的2193种具有细胞间差异的蛋白质中选择1180种在U2OS细胞中表达的蛋白质,使用免疫荧光技术并辅以转录组学分析深入研究这些蛋白质的定位和丰度。以ANLN蛋白(一种细胞周期调节器)为例(Fig.1f),在细胞周期中核丰度增加,并表现出相似的RNA表达时间分布。相反,SCIN蛋白在细胞核中显示出与细胞周期无关的细胞间差异。研究者通过单细胞蛋白基因组学方法系统地记录了细胞周期中核糖核酸和蛋白质的时间表达模式。
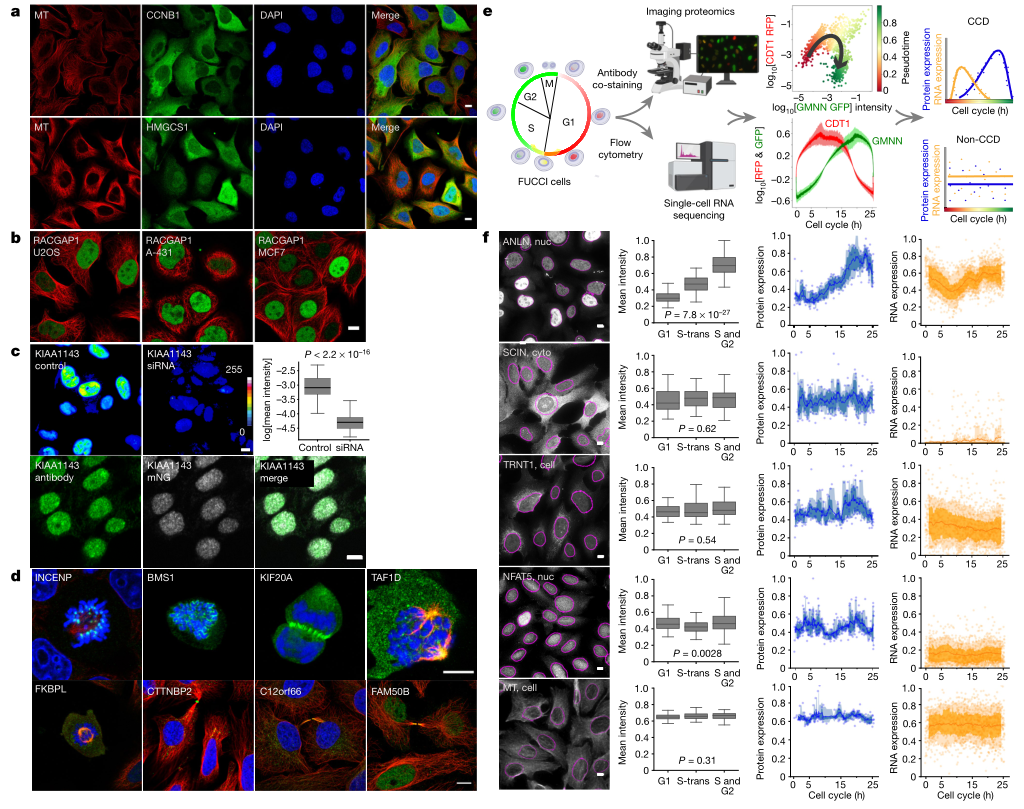
(Fig.1)
2. 细胞周期相关变异的蛋白基因组剖析
研究人员发现有300多种蛋白质表达水平的变化与细胞分裂间期呈时间相关性(Fig.2a)。另一组细胞周期依赖(cell-cycle-dependent, CCD)蛋白质,在有丝分裂结构中被观察到,但在时间上与间期进程无关。研究者通过分析单细胞转录组测序(single-cell transcriptomic sequencing, scRNA-seq)数据来研究细胞周期蛋白的时间调节是否可以归因于转录物循环。在UMAP和反映间期进展的RNA速度流中可以清楚地看到细胞循环(Fig.2c)。在使用FUCCI模型计算的相应时间的背景下分析单细胞转录物表达,能够鉴定401个CCD蛋白编码基因,包括一百多个新的CCD基因。在基因水平和亚型水平,CCD蛋白与相应的CCD转录物有明显的小重叠。CCD蛋白质和转录物之间的这种小重叠被外部RNA数据集所证实,表明蛋白质组循环的时间动力学在很大程度上受翻译或翻译后调控。为了研究细胞周期转录组和蛋白质组的时间动态,研究者比较了RNA和蛋白质表达峰值的时间(Fig.2d)。G1期是细胞周期中最长的时期,在此期间大多数RNA的表达达到峰值。大多数蛋白质在细胞周期结束时(S期和G2期晚期)达到峰值。同时还观察到73个具有循环转录物的CCD蛋白质,其RNA和蛋白质表达峰值之间平均延迟8.6小时(Fig.2e)。这种延迟的持续时间与昼夜周期中的报道相当。研究者通过比较CCD和非CCD蛋白质磷酸位点上游的激酶对PTM调节的差异进行研究,结果表明PTM可以调节蛋白质的循环而不需要循环转录物,PTM调节可以将单个细胞之间的非CCD蛋白质组学变化与包括代谢在内的多种途径联系起来。
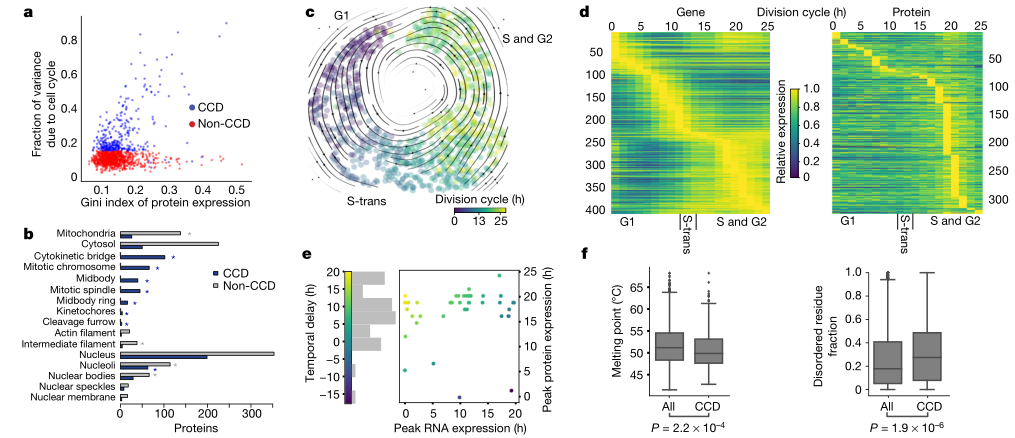
(Fig.2)
3. 细胞周期时间表达谱
时间表达谱的相似性表明人类蛋白质组在间期随着时间的推移而划分。研究者对已知的和新发现蛋白都观察到这种效应,表明它们在表达时间上相关(Fig.3a)。共享的亚细胞定位可以作为另一个重要的关联细胞周期蛋白。观察CCD蛋白的多种亚细胞定位可以提示易位。最终发现,在G1早期,新的CCD脱氢酶UGDH从细胞质转移到细胞核,随后细胞核丰度逐渐增加,直到G2达到峰值表达(Fig.3b)。
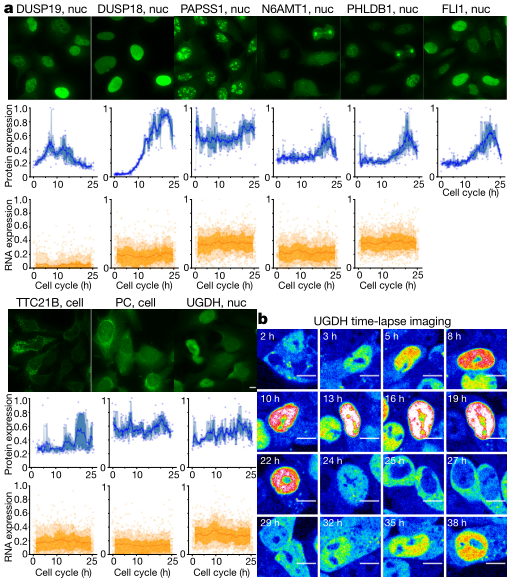
(Fig.3)
4. 新的细胞周期调节蛋白的功能关联
为了验证新的CCD蛋白对细胞增殖的功能重要性,研究人员分析了基因表达、功能丧失和癌症预后数据集。新的CCD蛋白与人类组织和癌症的增殖活性相关,它们在增生组织中的表达水平高于非增生组织。CCD蛋白对应于细胞生存基因,支持了这些基因作用于细胞增殖的假设。通过对几种新的CCD蛋白进行siRNA介导的基因沉默实验也验证了这些假设(Fig.4b)。由于细胞增殖在肿瘤发生中很重要,研究人员同时研究了编码CCD蛋白的基因是否与癌症患者的预后相关,发现预后相关性高达69%,支持了这些基因在细胞增殖中起功能作用的假设,这些新的CCD蛋白可能作为潜在的诊断或治疗癌症的靶点。
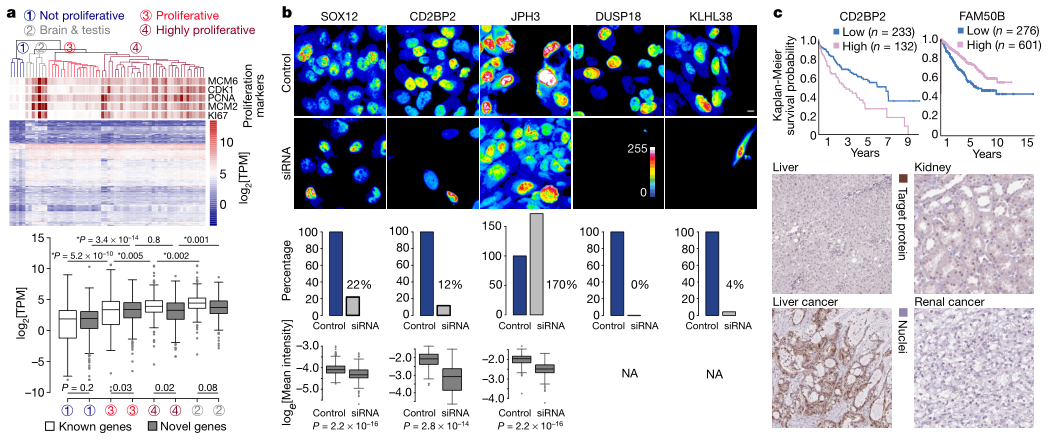
(Fig.4)
总结:研究者在非同步的人类细胞中创建了一个具有单细胞分辨率的人类细胞周期时空分辨图。这项工作系统地描述了RNA和蛋白质在细胞周期中的时空表达模式。此项研究整合了单细胞转录组测序和针对性的单细胞蛋白质组成像策略,这些蛋白质表现出细胞间的差异性,并在FUCCI U2OS细胞中表达。研究者报道称约五分之一人类蛋白质组显示了细胞间的差异性,并确定了数百种依赖细胞周期的蛋白质。结果表明,大多数CCD蛋白是翻译后调节,并非通过转录周期调节,且CCD蛋白具有更高的内在蛋白紊乱和不同激酶家族磷酸化作用,这表明了与蛋白质组的整体结构和功能差异。此外,研究者还利用基因沉默和预后关联分析来证明某些CCD蛋白具有致癌或抑癌特性。这些结果更完整地描述了单个人类细胞之间的细胞分裂周期和蛋白质组差异性,对于理解这些基本生物学过程和新出现的增殖性疾病的分子基础至关重要。
原文链接:https://doi.org/10.1038/s41586-021-03232-9
参考文献:
https://www.whbzb.com/swzy/4413.html