文献研读|金莲(2019级博士):Cell | 无膜结构的胞质蛋白颗粒介导的RAS信号通路
摘要
近期,加州大学旧金山分校血液学与肿瘤学学系Trever G. Bivona团队在《Cell》上发表了一项研究,首次揭示了哺乳动物细胞中RTKs融合癌蛋白从头组装形成无膜的胞质蛋白颗粒,作为组织RTK信号通路的亚细胞平台,以脂质膜非依赖的方式激活RAS及下游信号通路。
研究背景
受体酪氨酸激酶(RTK)/RAS/MAP激酶(MAPK)信号通路在调节正常人类细胞的增殖和存活方面具有重要意义,在人类癌症中经常通过各种机制被过度激活。长期以来,典型的RTK信号被认为只发生在如质膜和胞内细胞器等脂质膜亚细胞区室。RTK/RAS/MAPK信号常导致RTKs(如间变性淋巴瘤激酶(ALK)和转染重排基因(RET))发生染色体重组,进而产生嵌合癌蛋白。天然的RTKs是完整的膜蛋白,然而几乎所有致癌的ALK和RET融合蛋白都保留了包括激酶在内的胞内结构域,缺失了跨膜结构域。作为一种新兴的亚细胞区室化机制,基于蛋白质的分子凝聚体为缺失跨膜结构域RTKs的融合癌蛋白如何组织信号传导提供了新的理论依据。
研究结果
本研究以先前报道过的棘皮微管相关蛋白样4 (EML4)-ALK融合癌蛋白作为主要研究对象。EML4-ALK以蛋白颗粒的形式存在于细胞质中,外观呈现出多孔的曲线型结构,在生物物理性质上具有更普遍的固体性质(Fig. 1)。
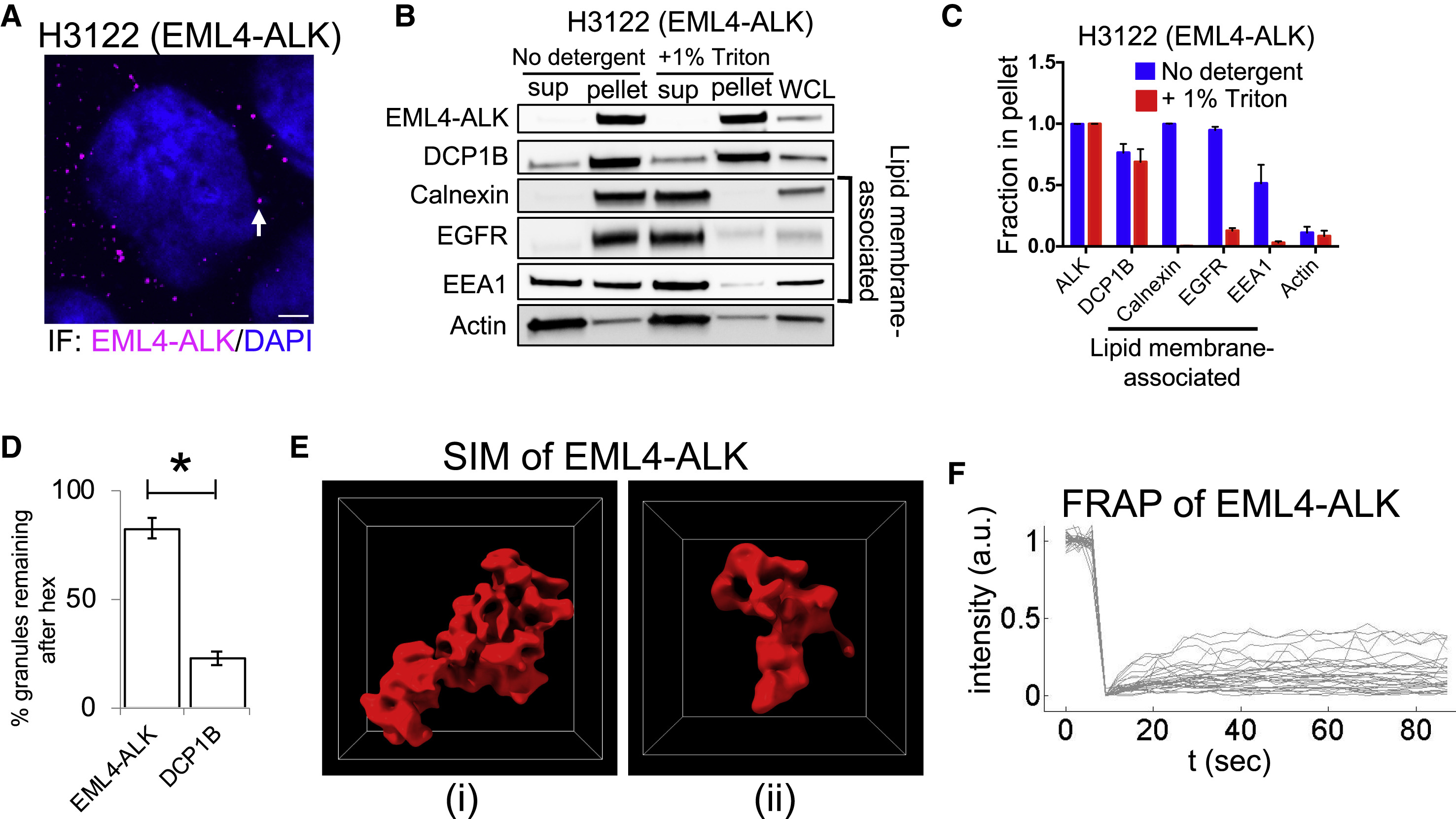
Fig. 1 EML4-ALK forms de novo membraneless cytoplasmic protein granules
与经典的RTKs激活下游RAS信号通路一致,EML4-ALK作为无膜结构的融合蛋白颗粒,招募RAS激活蛋白复合物GREB2/SOS1/GAB1(Fig. 2,未显示)。通过使用去除脂质膜靶向的RAS突变体,验证了EML4-ALK以脂质膜非依赖的方式激活胞质RAS,最后,通过tandem GFP-RBD (RAS-binding domain) live-cell reporter确定EML4-ALK局部激活RAS(Fig. 3,Fig. s3(未显示))。
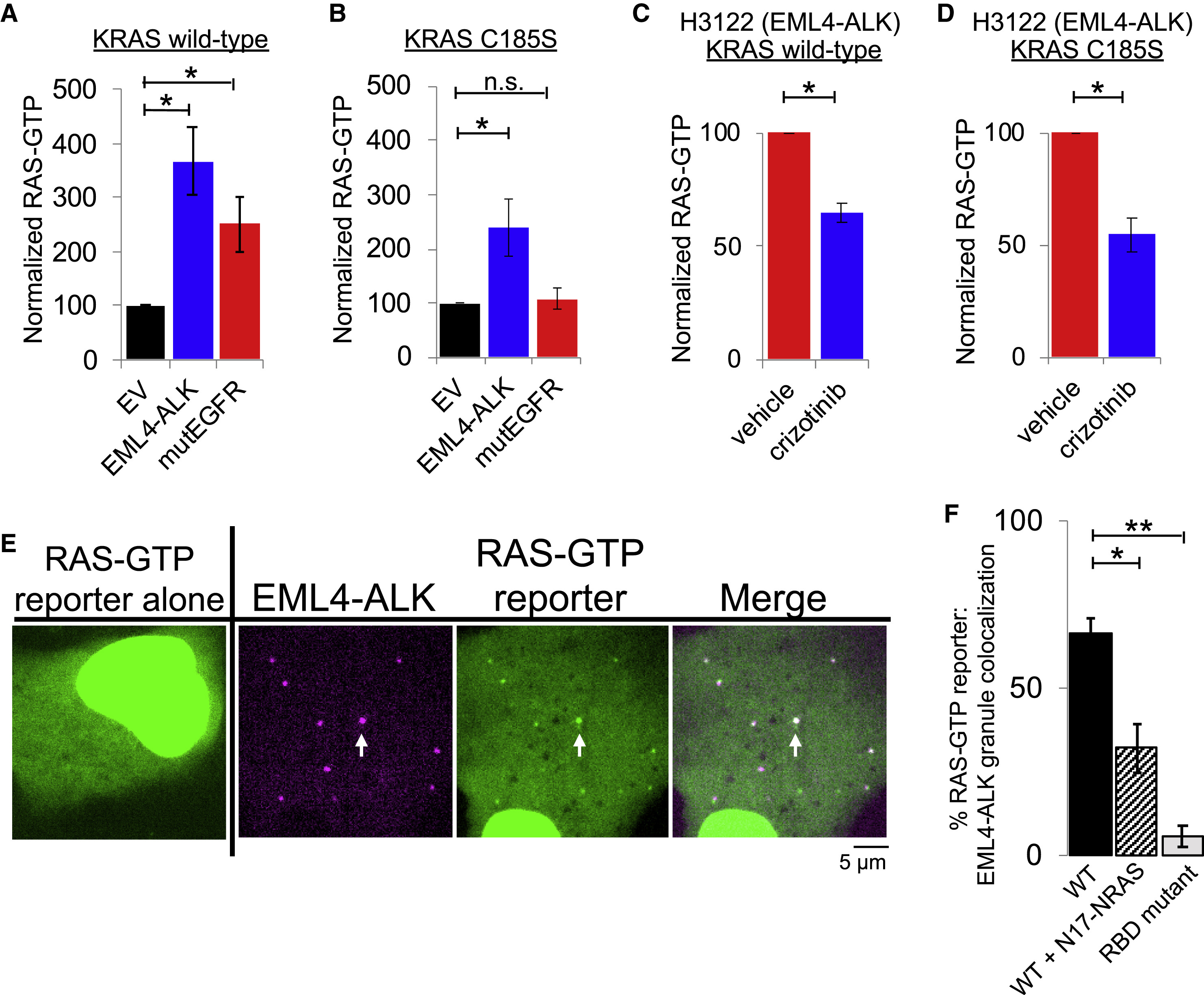
Fig. 3 Cytoplasmic EML4-ALK protein granules locally activate RAS
EML4-ALK融合蛋白中,EML4的两个结构域(TD domain和HELP domain)对介导下游RAS/MAPK信号输出至关重要,而ALK与接头蛋白GRB2的磷酸化位点对接,促进凝聚体形成(Fig. 4 A-F)。其中GRB2的SH2结构域负责与酪氨酸磷酸化位点的结合,SH3结构域可能通过招募SOS1和GAB1以外的其他相互作用蛋白来增加共价结合,从而促进蛋白颗粒形成(Fig. 4 G-L)。
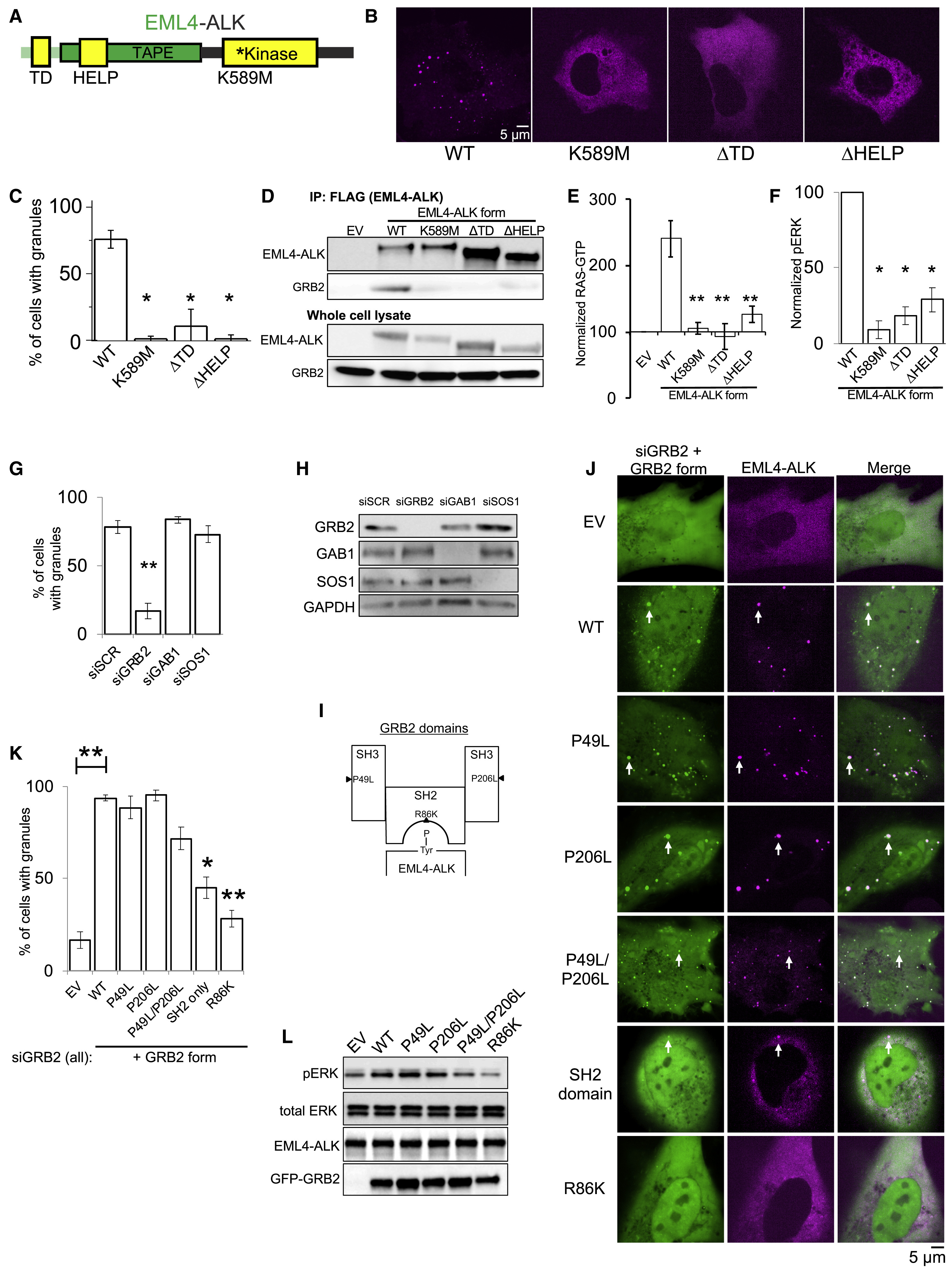
Fig. 4 Protein granule formation by EML4-ALK is critical for RAS/MAPK signaling
具有完整的激酶活性EML4-ALK蛋白颗粒可以在空间上集中、组织和启动RAS/MAPK信号通路(Fig. 5,未显示)。除了EML4-ALK蛋白颗粒,其他RTKs融合蛋白也具有相似功能,如天然存在于癌症患者中的CCDC6-RET融合蛋白颗粒,也能激活RAS/MAPK信号通路,但二者在激活机制上存在阈值差异(Fig. 6),CCDC6-ALK的CC domain足以促进蛋白颗粒形成,即CCDC6-ALK以激酶非依赖型的方式促进颗粒形成;而EML4-ALK需要激酶活性促进颗粒形成,即激酶依赖型。
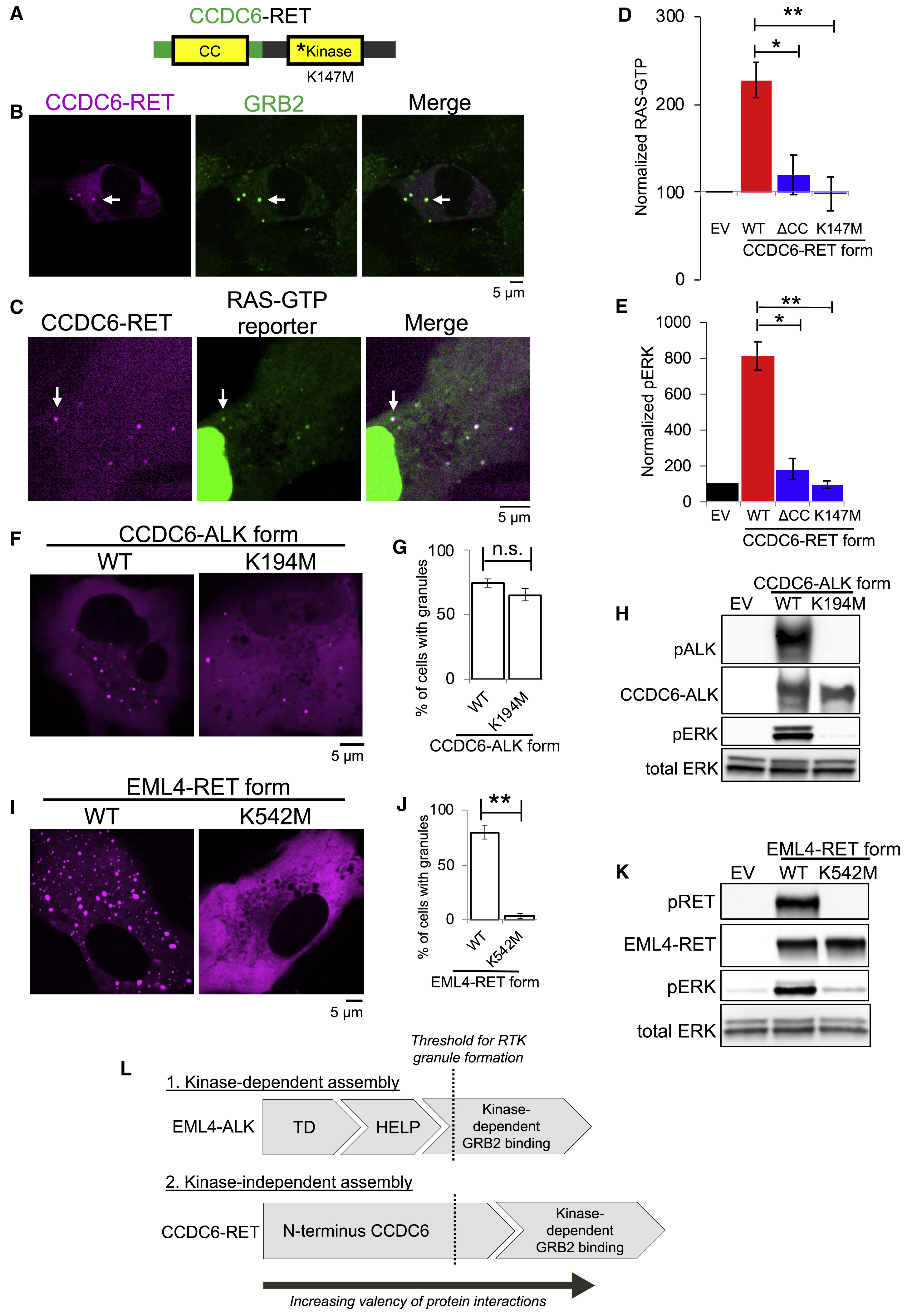
Fig. 6 Cytoplasmic granule formation is a general mechanism for RTK-mediated RAS/MAPK pathway activation in cancer
对更广泛的无膜RTKs蛋白颗粒的信号蛋白富集筛选结果显示,共有的RTKs颗粒组分包括GRB2、SHC1、PIK3R1 (p85)和PLCγ1,SHP2、SOS1、GAB1和支架蛋白IRS1、CNKSR1和CNKSR3也是富集成分。值得注意的是RAS激活蛋白显著富集,而RAS的负调控因子GAP缺失,这为RTKs蛋白颗粒产生强大的RAS/MAPK输出提供了一个可能的解释(Fig. 7 A-F,Fig. s7(未显示))。此外,RTKs蛋白颗粒对PI3K-AKT、JAK-STAT等通路也具有激活效应,提示该机制可能是具有广谱性的通路调控机制(Fig. 7G)。
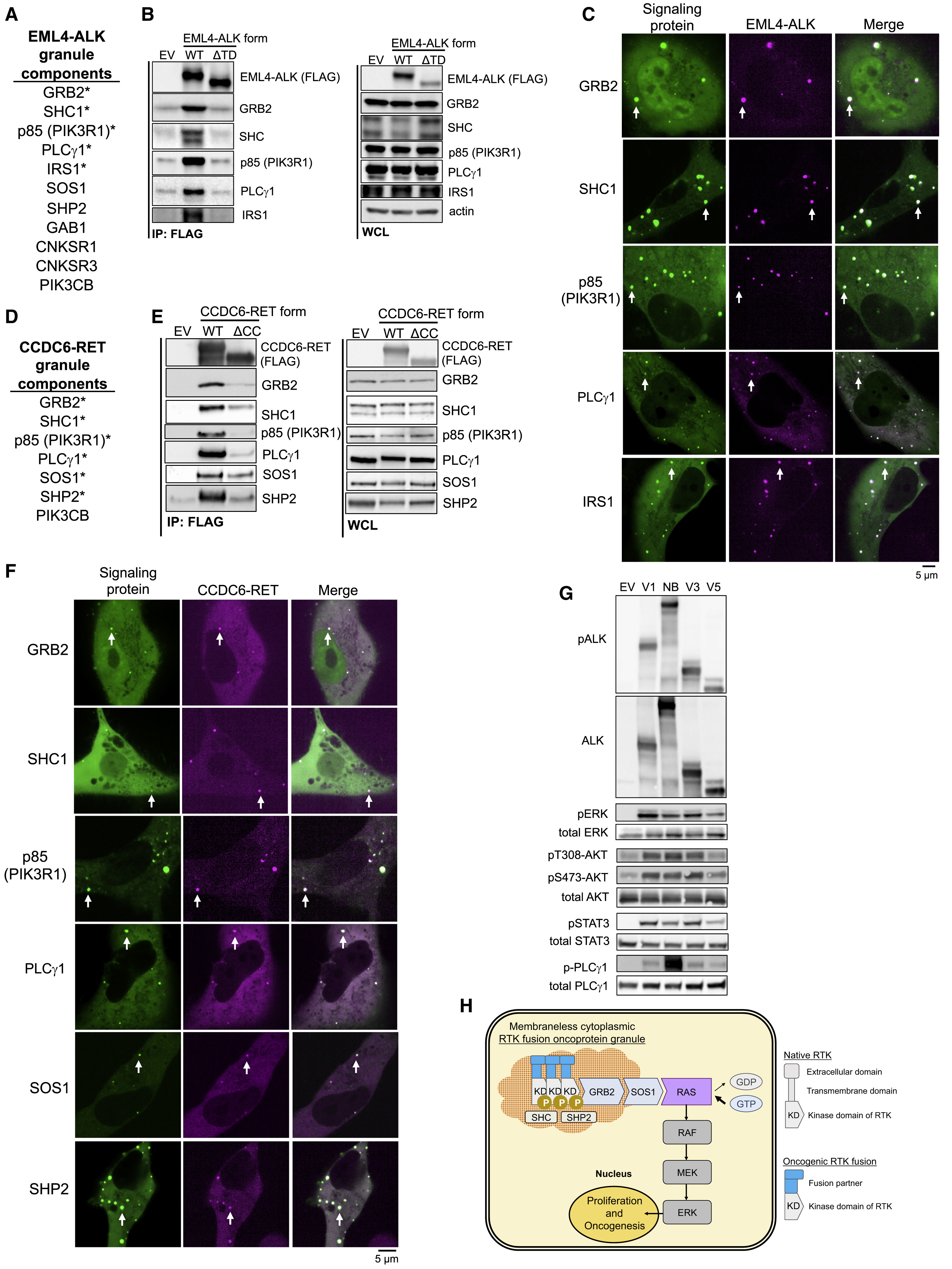
Fig. 7 Signaling architecture of membraneless RTK protein granules
研究总结
本研究揭示了RTKs融合癌蛋白EML4-ALK和CCDC6-RET从头组装形成无膜的亚细胞区室,以脂质膜非依赖的方式激活局部RAS,驱动致癌信号的传导(Fig. 7H)。该机制补充了经典的依赖脂质膜的RTK/RAS/MAPK信号通路激活方式,为缺失跨膜结构域的RTKs如何组织下游信号通路提供了可能的解释。然而,RTK融合癌蛋白的高级组装形式对驱动致癌信号的影响尚不清楚,更广泛的RTKs融合癌蛋白结构特异性也有待针对性研究。从研究应用上来说,RTKs融合癌蛋白可以作为癌症治疗的新靶标,通过破坏融合蛋白颗粒的组装和功能阻断致癌信号传导,为普遍存在的靶向RTK/RAS/MAPK信号通路的激酶抑制剂产生的耐药性问题提供另一种治疗方案。
该研究发表于《Cell》,原文链接:https://www.cell.com/cell/fulltext/S0092-8674(21)00362-7