文献研读|李艳(研究员):Cell | 心脏类器官揭示人类心脏发生过程中的自组织原理
2021年5月20日,国际学术期刊《Cell》在线发表了一篇由奥地利科学院分子生物技术研究所(IMBA)Pablo Hofbauer、Stefan M. Jahnel、Nora Papai等研究人员合作完成的文章。他们在文章中详细描述了通过人类多能干细胞,培养具有房室结构的自组织心脏类器官的过程。这项研究对于器官自组织、先天性心脏病致病机制、器官移植等研究领域都具有里程牌式的意义。
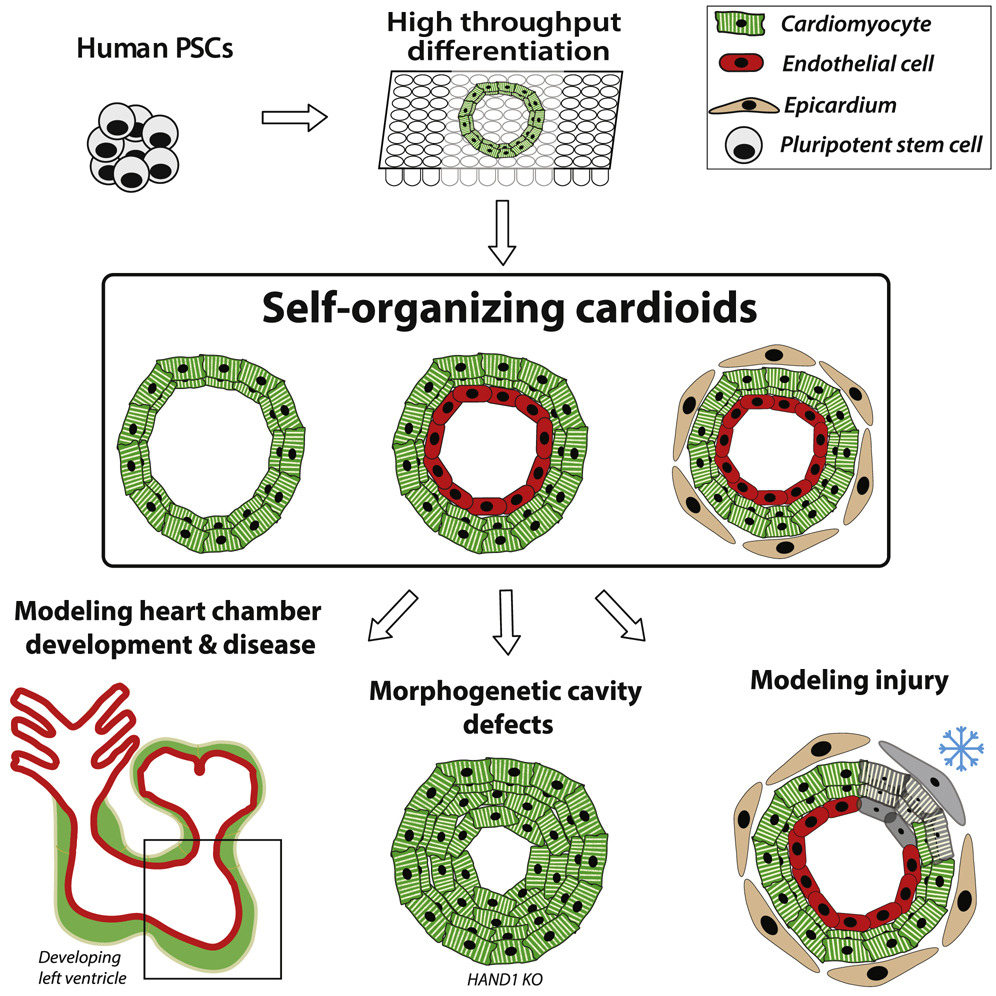
心脏,既是胚胎发育中最先形成的功能器官,也是体外类器官培养难题的制高点。心脏发育缺陷是最常见的人类出生缺陷,但目前对其发育缺陷产生的原因仍知之甚少。根据已有的动物和细胞模型,目前已知心脏由中胚层细胞在特定时期分化而来,形成心肌细胞(cardiomyocyte)、心内膜细胞(endocardial)和心外膜细胞(epicardial),但不清楚这几类细胞如何自我组装成不同的层次、心脏房室结构,为何会产生心脏缺陷。在一个快速变化的复杂发育过程中解析这些疑问绝非易事,但体外类器官模型来自相对单一的培养环境,且能充分反应体内的发育过程,因此是解析心脏发生复杂机制及其缺陷产生机制的重要方式。
类器官由人类多能干细胞或成人干细胞培养而来。这些干细胞通过不同的信号通路诱导形成类似组织的结构,具有器官特异的细胞类型,并表现出器官特异的功能。虽然目前绝大部分的类器官已培养成功,但心脏类器官仍未攻克。目前利用生物工程学的方法已可构建人工心脏组织;利用人或者小鼠多能干细胞能培养出具有心肌细胞和其他心脏细胞类型的3D微型球状模型;早期器官发育过程中分化成心脏和非心脏的胚层间互作关系也得到了进一步揭示,然而仍然缺乏能够自组织成房室结构的心脏类器官模型。
研究人员表示,为了体外自发诱导分化出类似房室的3D结构,他们发展了一个通过在空间上控制心脏发生的关键通路来诱导分化的方法,并成功培养出了以心肌细胞为主要构成的具有房室结构的心脏类器官。
心脏类器官空腔形成不同时期的结构和分子分析表明,空腔形成过程始于表达HAND1的心脏中胚层时期。心脏中胚层具有自组织的能力,使自身特异化、自发排列成不同的中胚层细胞层,并自导形态发生形成腔室。
在心脏类器官自发组装过程中,WNT和BMP通路起到了主导作用。高剂量的WNT在心肌细胞没有特异化的情况下促使空腔形成;而抑制BMP使空腔形态受损,心脏类器官体积变小。WNT、BMP联合下游的HAND1组成WNT-BMP-HAND1轴,进而控制心脏类器官空腔结构的自组织。WNT、ACTIVIN和VEGF进一步协同促进心内膜细胞和心肌细胞的自组织。
心脏类器官的成功培养,使深入认识心脏发育损伤成为可能。通过冷冻损伤心脏类器官,可以引发与体内反应类似的纤维连接蛋白和胶原蛋白的聚集,清楚解析心脏损伤时不同类型特异细胞的应激过程,重现心脏再生及早期纤维化反应的重要变化。
“总而言之,该心脏类器官平台为探讨自组织、自发缺陷产生的功能机制提供了广泛的研究潜力,将引导更加成熟和复杂的人类心脏模型的开发,并促进药物开发及再生医学的研究”,作者写道。
原文检索:Hofbauer, P., Jahnel, S.M., Papai, N., et al. Cardioids reveals self-organizing principles of human cardiogenesis. Cell (2021), DOI: https://doi.org/10.1016/j.cell.2021.04.034