阳离子柱[6]芳烃(cPA6)促进肿瘤细胞凋亡的作用机制
卢宇勋
摘要
阳离子柱[6]芳烃(cPA6)通过主客体识别,包合底物蛋白的酪氨酸位点,有效地抑制酪氨酸蛋白的磷酸化诱导癌细胞凋亡,从而抑制癌细胞增殖(如图1所示)。该项学科交叉的研究成果,由云南大学生命科学学院张亚平院士团队和化学科学工程学院李灿鹏教授团队联合开展完成,并发表于《International Journal of Molecular Sciences》杂志。
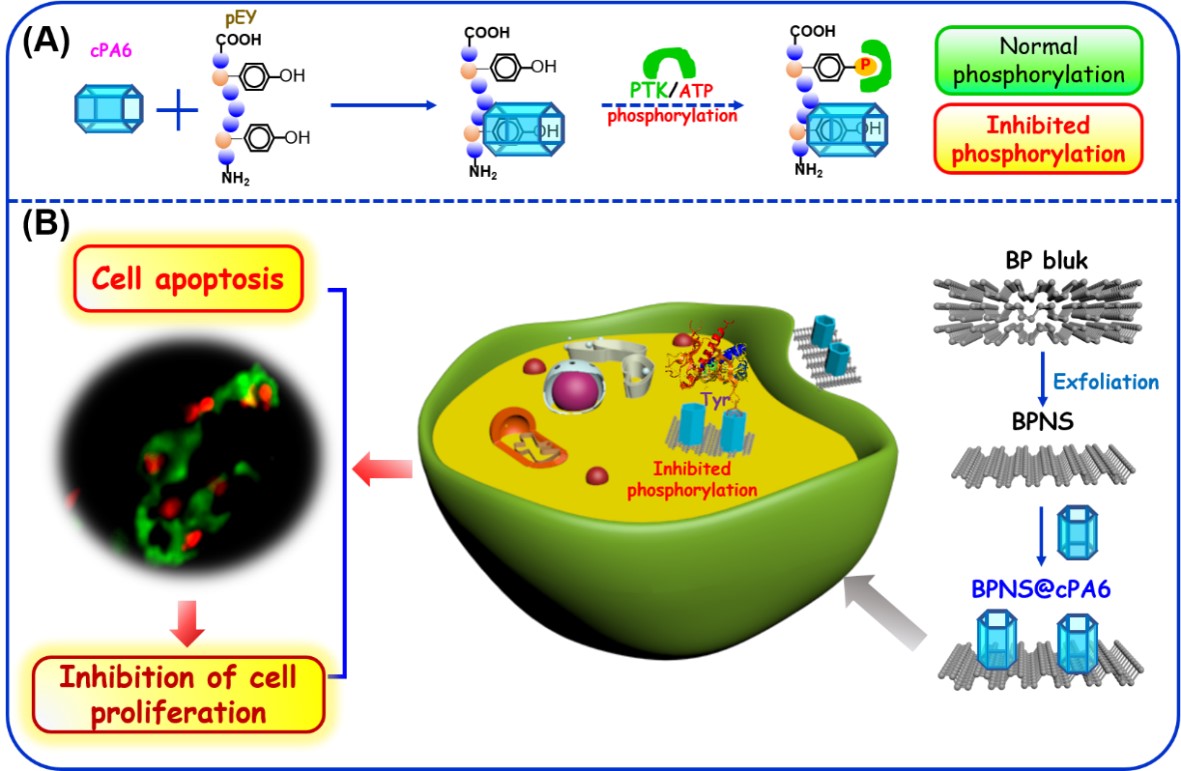
图1. cPA6介导的抑制Tyr磷酸化机制的原理图,图片来源(International Journal of Molecular Sciences)
正文
研究背景
酪氨酸(Tyr)蛋白磷酸化是一种与肿瘤发生发展密切相关的生物学过程,主要受酪氨酸蛋白激酶(protein tyrosine kinase,PTK)调控。由PTK调控的Tyr蛋白的异常磷酸化是肿瘤发生的原因之一,因此通过设计靶向作用PTK而抑制Tyr磷酸化的药物已经被研发,并用于癌症的治疗。但是这些小分子药物往往只能针对一种或者几种PTK,并在治疗过程中由于出现基因突变而导致耐药性的产生,因此寻求一种新的抑制酪氨酸磷酸化的方法是十分重要的。
研究结果
与传统抑制酪氨酸磷酸化的方法不同,研究人员着眼于发生Tyr磷酸化的底物分子,利用大环分子包和底物上的Tyr磷酸化位点,从而实现抑制Tyr磷酸化。首先研究人员对多种大环分子进行筛选,发现与环糊精、杯芳烃等大环分子相比,阳离子柱[6]芳烃(cPA6)的抑制效果最强,Tyr磷酸化的抑制率可达68.76%(图2)。进一步,研究人员通过分子对接实验证实cPA6能够包和底物pEY上Tyr位点上的羟基(图3)。
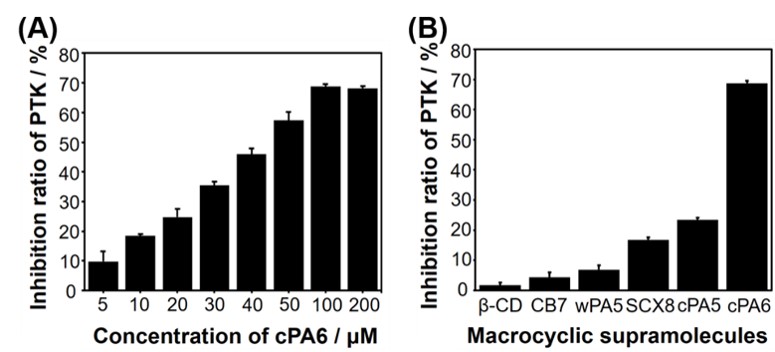
图2. cPA6对Tyr磷酸化的抑制效果和其他大环分子的比较,图片来源(International Journal of Molecular Sciences)
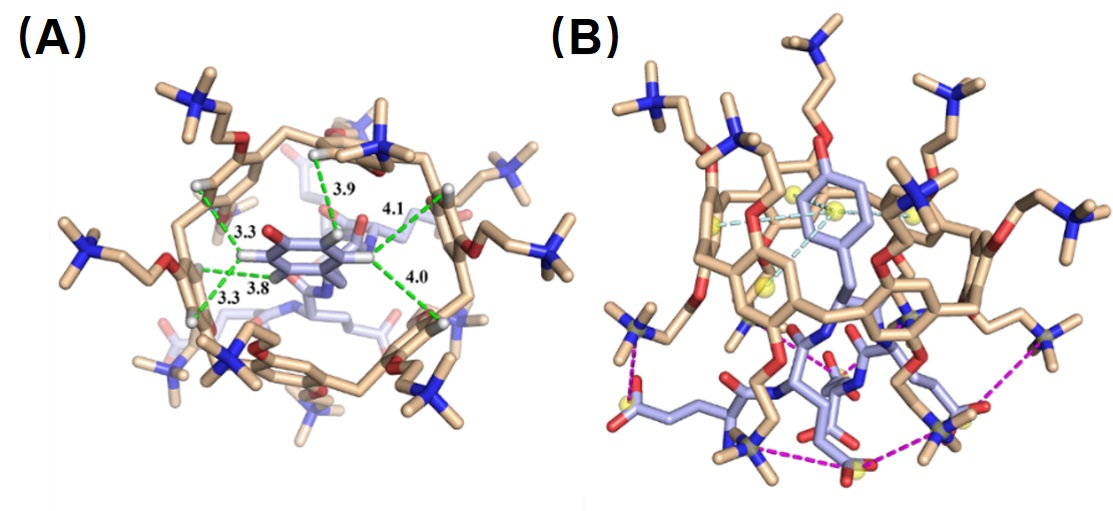
图3. 形成cPA6/ pEY 主客体复合物的分子对接结果,图片来源(International Journal of Molecular Sciences)
由于cPA6是大环分子难以进入细胞,而且很难示踪,因此研究人员通过合成BPNS@cPA6纳米复合材料,利用BPNS作为载体,使cPA6能够顺利进入细胞并示踪。利用热重、红外光谱、拉曼光谱等方法表征了纳米复合材料的成功制备(图4)后,进一步探究该材料对细胞酪氨酸磷酸化和细胞活性的影响。
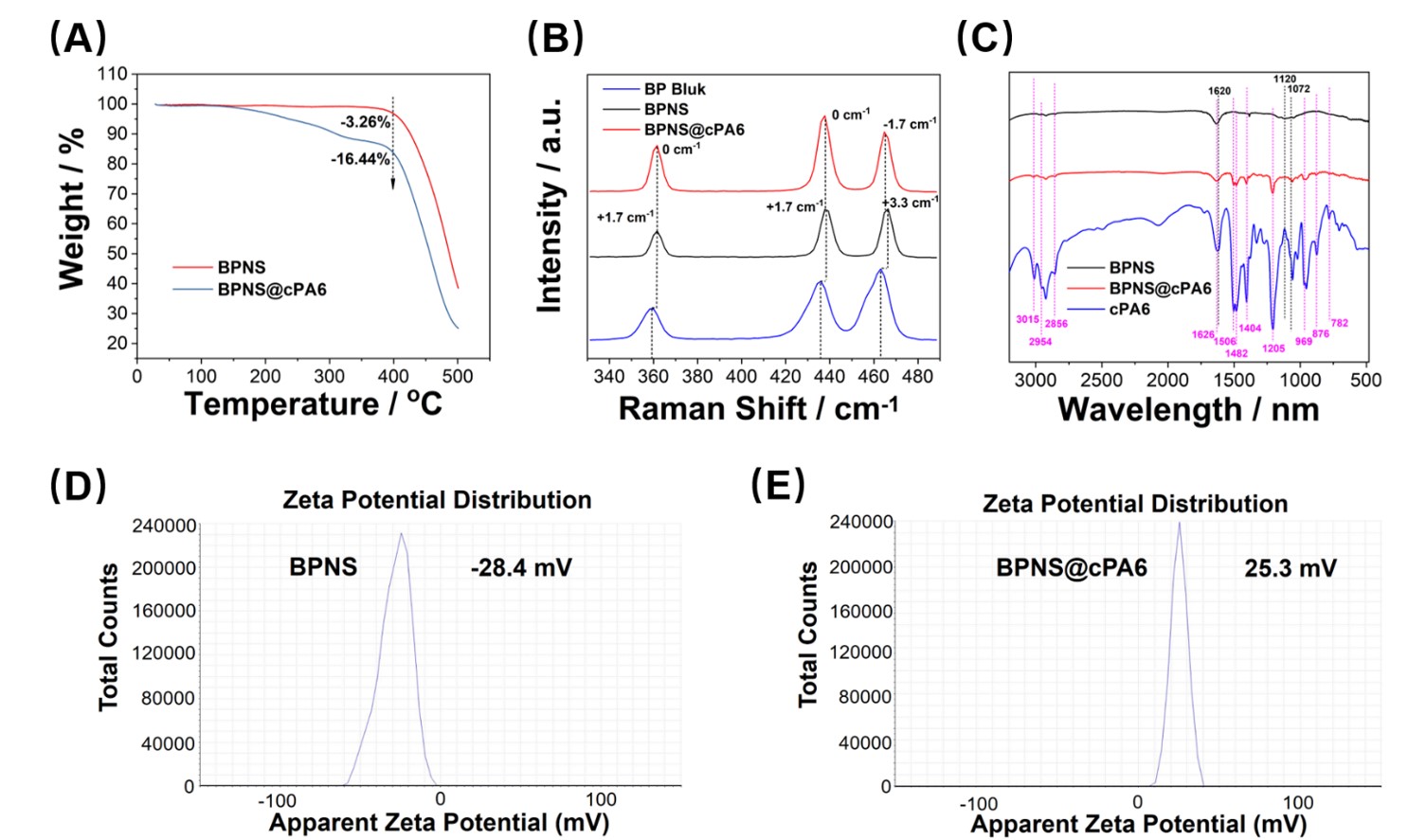
图4. BPNS@cPA6纳米复合材料的表征结果,图片来源(International Journal of Molecular Sciences)
通过Western blot实验证实,该材料显著抑制了肝癌细胞HepG2的酪氨酸磷酸化水平(图5A)。通过CCK-8法发现该材料显著抑制HepG2的细胞活性,并具有浓度依赖性(图5B)。进一步,通过细胞荧光成像证实确实是BPNS@cPA6纳米复合材料中的cPA6引发了肿瘤细胞的细胞凋亡(图5C)。
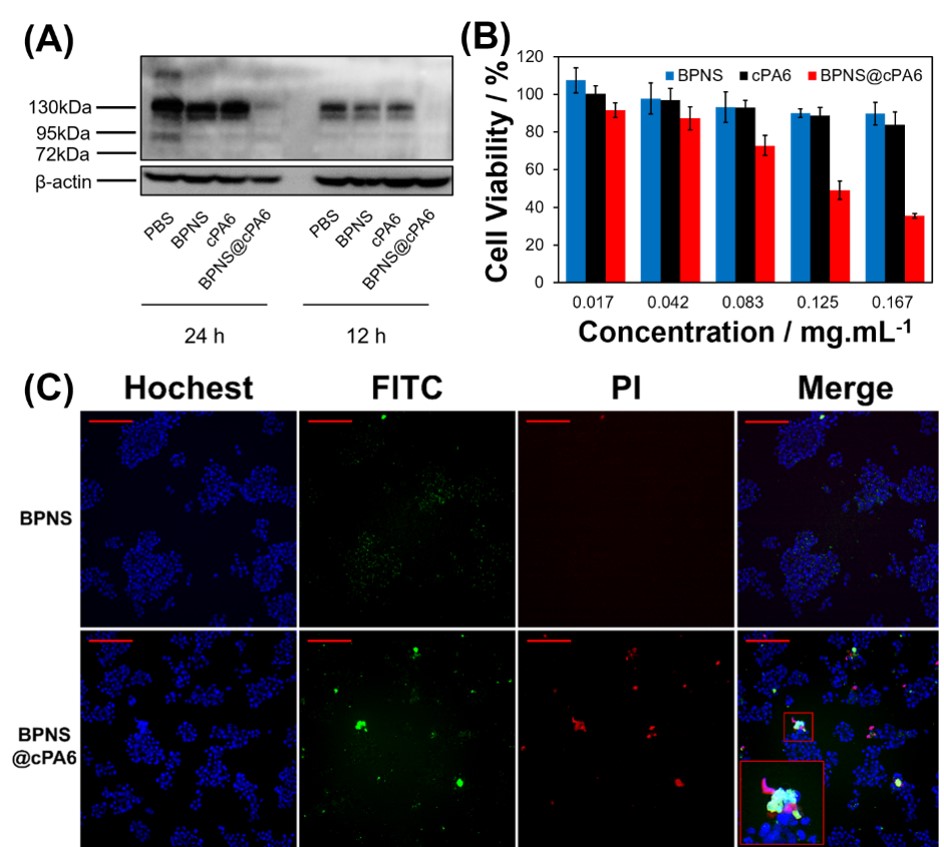
图5. BPNS@cPA6纳米复合材料肝癌细胞HepG2的细胞增殖和凋亡,图片来源(International Journal of Molecular Sciences)
最后,研究人员探究了该材料对多种细胞的活性的影响,发现该纳米复合材料抑制肿瘤细胞的活性效果要强于正常细胞(表1,IC50值越小,材料对细胞活性的影响越大),其原因可考虑为两点:一是肿瘤细胞中酪氨酸磷酸化的本底水平比较高,材料更容易发挥作用;二是肿瘤细胞表面的负电荷更多,更容易富集带正电荷的cPA6的纳米复合材料。
表1. 纳米材料对多种细胞活性的影响结果,数据来源(International Journal of Molecular Sciences)
Cell type |
Cell line |
IC50 ( mg.mL-1) |
Cancer cell |
HepG2 |
0.1229 |
|
BT474 |
0.1586 |
|
LNCaP |
0.1901 |
Normal cell |
L-02 |
0.2752 |
|
MCF10A |
0.2833 |
|
293T |
0.2791 |
总结
此研究通过化学与生物的学科交叉,首次揭示了一种抑制酪氨酸磷酸化的新机制,即阳离子柱[6]芳烃通过包和关键蛋白的酪氨酸位点,抑制酪氨酸的磷酸化,进而抑制肿瘤细胞的活性,促进细胞的凋亡。该研究为基于酪氨酸磷酸化抑制作用的肿瘤治疗提供了新思路和理论基础。
相关研究成果已发表于《International Journal of Molecular Sciences》,原文链接:https://www.mdpi.com/1422-0067/21/14/4979